Saúde
Nova compreensão sobre os sinais imunológicos que impulsionam a inflamação na esclerose múltipla
A esclerose múltipla (EM) é uma doença neurológica crônica caracterizada por danos nos nervos e consequentes comprometimentos da visão, movimento, equilíbrio e função mental.
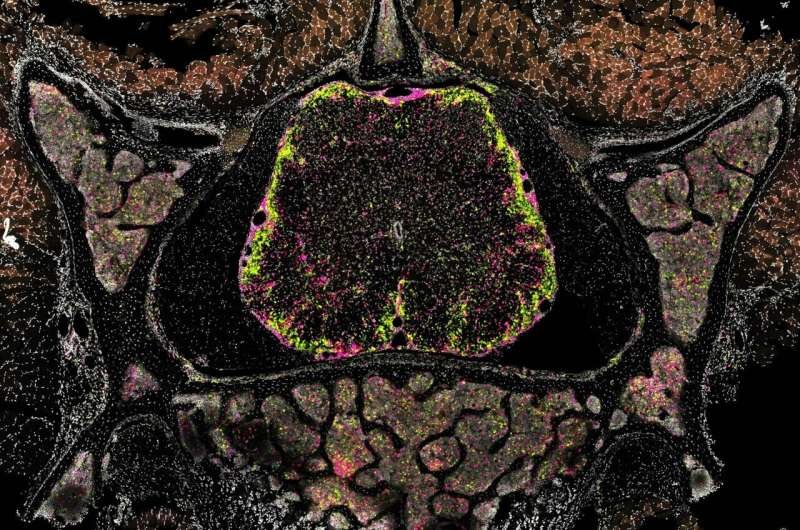
Imagem representativa de microscopia confocal de uma secção transversal da coluna vertebral completa de um animal com EAE submetido a co-transferência de células de controlo (vermelho) e células Tgfbr1-KO (verde). Crédito: de la Rosa, Kendirli et al.
A esclerose múltipla (EM) é uma doença neurológica crônica caracterizada por danos nos nervos e consequentes comprometimentos da visão, movimento, equilíbrio e função mental. Na EM, o sistema imunológico ataca erroneamente a mielina, a bainha protetora que envolve os axônios (ou seja, as fibras nervosas) no cérebro, na medula espinhal e nos nervos ópticos.
Os macrófagos, células imunes responsáveis por detectar e eliminar células danificadas, germes ou outros detritos no sistema nervoso central (SNC), desempenham um papel fundamental na esclerose múltipla (EM). Essas células podem assumir diferentes estados funcionais, associados tanto à inflamação quanto ao reparo de danos no SNC.
Pesquisadores da Universidade Ludwig-Maximilians de Munique e da Universidade Técnica de Munique realizaram recentemente um estudo com o objetivo de explorar mais a fundo a contribuição dos macrófagos para a neuroinflamação observada em pacientes diagnosticados com esclerose múltipla e algumas outras doenças neurológicas.
O artigo deles, publicado na Nature Neuroscience , apresenta uma nova abordagem para estudar as células imunológicas e os sinais que impulsionam seu comportamento em organismos vivos.
"Os macrófagos derivados de monócitos desempenham um papel duplo em condições neuroinflamatórias, contribuindo tanto para a progressão da doença quanto para o reparo tecidual", disse Arek Kendirli, coprimeiro autor.
"Essas ações opostas em modelos experimentais de EM destacam a notável plasticidade dos macrófagos. Em nosso trabalho anterior, mostramos que os macrófagos transitam de um fenótipo promotor de lesão, positivo para óxido nítrico sintase induzível (iNOS), para um estado de resolução de lesão caracterizado pela expressão de arginase-1 (Arg1). No entanto, os sinais moleculares que governam essas transições in vivo — particularmente dentro do sistema nervoso central inflamado — permanecem pouco compreendidos."
O principal objetivo do recente estudo de de la Rosa e Kendirli e seus colegas foi investigar os mecanismos moleculares que impulsionam o comportamento dos macrófagos em organismos vivos, examinando vários genes e sinais simultaneamente. Para isso, eles desenvolveram uma nova abordagem experimental que se baseia em uma técnica chamada triagem CRISPR para desativar vários genes em camundongos vivos e observar os efeitos associados.
A maioria dos estudos anteriores aplicou técnicas de triagem CRISPR in vitro, em vez de em organismos vivos. Estudar os efeitos da inativação de genes específicos em animais vivos, no entanto, captaria de forma mais realista a complexidade do SNC e o comportamento de populações celulares específicas.
"Estamos interessados em macrófagos no contexto da esclerose múltipla porque são as células mais abundantes nas lesões ativas e têm essa dupla capacidade de causar danos, mas também de contribuir para a reparação", disse Clara de la Rosa, coautora principal do artigo.
"Portanto, existe um grande potencial terapêutico inexplorado em direcionar esse tipo de célula para mudar o equilíbrio da doença, transformando-a de danosa em reparadora, mas atualmente não existem terapias que a visem ativamente."
Um método promissor para estudar células imunes de camundongos
Alguns dos colaboradores de Kendirli e de la Rosa já haviam criado um tipo de célula progenitora imortalizada de camundongo, conhecida como células Hoxb8. Essas células podem se dividir indefinidamente em laboratório sem morrer e podem se desenvolver em dois tipos principais de células imunes: células mieloides (como macrófagos, monócitos e neutrófilos) e células linfoides (como células T, células B e células natural killer).
Como as células mieloides não têm uma vida muito longa, os pesquisadores começaram a explorar a possibilidade de transferir células Hoxb8 diferenciadas em células mieloides para camundongos vivos. Isso, por sua vez, permitiria que eles modelassem o ciclo de vida completo das células mieloides em um organismo vivo.
"A capacidade das células Hoxb8 de serem cultivadas a longo prazo as tornou ideais para a introdução de construções CRISPR", explicou Kendirli. "Transplantamos essas células editadas em camundongos com encefalomielite autoimune experimental (EAE) induzida cerca de uma semana antes do pico da doença, permitindo que elas adotassem completamente o fenótipo de macrófagos endógenos."
"Utilizando essa abordagem, analisamos mais de 100 receptores de citocinas e componentes de sinalização. Identificamos IFN-y, TNF-a, GM-CSF e TGF-B como reguladores-chave da polarização de macrófagos in vivo, enquanto IL-4, IL-10 e IL-13 — moduladores bem conhecidos in vitro — não direcionaram a polarização de macrófagos in vivo neste modelo de EM no ponto de tempo examinado."
A técnica CRISPR, empregada pelos autores, é uma técnica de edição genética que permite aos neurocientistas atingir vários genes simultaneamente. Isso, em última análise, reduz o número de experimentos necessários para desvendar os processos moleculares que impulsionam o desenvolvimento e o comportamento das células.
"Como explicou Arek, primeiro tivemos que adaptar um método que funcionasse para realizar triagens CRISPR em macrófagos em nosso modelo de doença", disse de la Rosa.
"Uma vez estabelecido esse método, pudemos rastrear genes de sinalização de citocinas e combinar CRISPR com transcriptômica de célula única e imagens intravitais e de tecido fixado para realmente investigar mais a fundo os efeitos das citocinas nas funções dos macrófagos."
Desvendando ainda mais os mecanismos subjacentes à neuroinflamação
Utilizando o método baseado em triagem CRISPR, os pesquisadores conseguiram obter novos conhecimentos sobre os processos moleculares que contribuem para a transição dos macrófagos para estados associados à neuroinflamação. A equipe identificou diversas proteínas de sinalização (isto é, citocinas) que controlam os estados dos macrófagos no cérebro de organismos vivos.
"Nosso método nos permite analisar centenas de genes em uma semana, em vez de gerar linhagens individuais de camundongos transgênicos para cada alvo", disse Kendirli.
"Ao combinar triagens CRISPR com tecnologias de célula única, agora podemos mapear fenótipos de macrófagos com resolução de célula única. Através de imagens intravitais de macrófagos editados em lesões da medula espinhal, podemos então observar seu comportamento diretamente no tecido vivo."
A abordagem dos pesquisadores para introduzir células precursoras imunes geneticamente modificadas em camundongos saudáveis e geneticamente não modificados permite maior flexibilidade experimental do que outros métodos experimentais introduzidos anteriormente. No futuro, a metodologia poderá ser usada para explorar outras funções das células macrófagas por meio de análises baseadas em biossensores.
"Na minha opinião, a contribuição mais importante do nosso estudo é metodológica", disse de la Rosa. "Nossa metodologia pode acelerar o ritmo das descobertas, reduzindo o trabalho e o número de experimentos necessários."
"Outra contribuição é a estrutura conceitual para o estudo aprofundado de genes candidatos que consideramos relevantes para a patologia em modelos animais, a fim de reunir informações suficientes que nos permitam aproveitar dados de doenças humanas para tentar determinar se a direção que tomamos com a pesquisa pré-clínica será relevante para pessoas com esclerose múltipla."
"Como muitas descobertas pré-clínicas não se traduzem bem em contextos clínicos, acho importante verificar sua relevância potencial durante nossa pesquisa básica em modelos de doenças."
Os planos de pesquisa futuros da equipe
Os métodos experimentais introduzidos por esta equipe de pesquisadores e as células precursoras que eles desenvolveram poderão em breve ser usados para estudar populações de células imunes específicas em diferentes órgãos e no contexto de diversas doenças.
Entretanto, Kendirli, de la Rosa e seus colegas planejam usar seu método para realizar triagens adicionais de CRISPR, com a esperança de descobrir genes que possam ser realisticamente alvejados por medicamentos farmacêuticos e que possam reduzir a neuroinflamação.
"Ao mesmo tempo, estamos trabalhando para entender melhor a dinâmica das transições de estado dos macrófagos", disse Kendirli. "Apesar dos avanços tecnológicos, muitos parâmetros — como a localização espacial precisa das células, o tempo de chegada e as interações com as células vizinhas — ainda moldam essas transições de maneiras que estamos apenas começando a desvendar."
Estudos anteriores têm observado consistentemente uma abundância de macrófagos em lesões do SNC associadas à EM, contudo, atualmente não existem tratamentos direcionados a essas células imunes. Os pesquisadores, portanto, planejam continuar investigando o papel dos macrófagos na EM, particularmente os processos moleculares que os levam a alternar entre estados relacionados à reparação tecidual e à inflamação.
"Agora que temos uma metodologia sólida, queremos aprofundar aspectos da biologia dos macrófagos que consideramos relevantes para uma mudança pró-reparação e que também podem ser alvos de mudanças no estilo de vida ou de medicamentos", acrescentou de la Rosa.
Por exemplo, será que algum alvo farmacológico conhecido desempenha um papel na regulação dos macrófagos? Existem alterações epigenéticas sensíveis ao estilo de vida e à idade que alteram a capacidade dessas células de serem mais ou menos pró-reparadoras ou pró-danificadoras? Ainda há muito a explorar.
Detalhes da publicação
Clara de la Rosa et al, Triagem CRISPR in vivo revela regulação de estados de macrófagos na neuroinflamação, Nature Neuroscience (2025). DOI: 10.1038/s41593-025-02151-6 .
Informações sobre o periódico: Nature Neuroscience